
El estrés oxidativo y por ende las denominadas especies reactivas del oxigeno (ERO) participan en los mecanismos etiopatogénicos primarios o en sus consecuencias en más de cien enfermedades de gran importancia clínica y social.
Desde Proust en 1774, al descubrir el oxigeno, pasando por los trabajos de Krebs y Szent-Gyorgy en la década del treinta del pasado siglo acerca de la respiración celular, se le ha brindado particular atención al papel protagónico que desempeña el oxigeno en el desarrollo de las reacciones metabólicas relacionadas con la vida, y en la producción de ERO en particular a partir de los trabajos de Joe McCord e Irwin Fridovich en la postrimerías de la década del sesenta.
Entre las ERO se encuentran átomos, iones y moléculas con uno o más electrones sin parear en su orbita más externa, que reciben el nombre de radicales libres lo que les aporta una alta capacidad reactiva, y moléculas derivadas del oxígeno como es el peroxido de hidrogeno.
Estas especies químicas pueden ser generadas por diversas fuentes, tanto internas, como pueden ser el metabolismo celular del oxígeno, los macrófagos activados y la peroxidación lipídica así como provenientes de fuentes externas, entre las que se encuentran el aire contaminado, el humo del cigarro, los alimentos enlatados, algunas sustancias carcinogénicas, determinados fármacos, la luz solar, las radiaciones ionizantes y los llamados choques térmicos, entre otros.
En los tejidos, el oxígeno sirve de sustrato de diversas reacciones bioquímicas intracelulares y, como resultado, se desencadena la producción de peróxido de hidrógeno (H2O2) y del anión superóxido. Se calcula que entre el 2 y el 5% del oxígeno consumido por las mitocondrias cardíacas es convertido en anión superóxido, dando lugar de esta forma a la posible generación de daño a las células del miocardio si estas no cuentan con los mecanismos capaces de neutralizar la acción de las ERO formadas en los procesos del fisiologismo celular.
De igual forma los radicales libres se producen en muchas células en otras condiciones fisiológicas, ejemplo de esto lo encontramos en los leucocitos al producir estos para combatir agentes externos, por lo que en este caso pudieran ser beneficiosos. Sin embargo, la mayor parte de las veces el cuerpo humano utiliza potentes mecanismos para evitar la acumulación de estos radicales libres con el fin de proteger a las células.

ACCIÓN PATOGÉNICA DE LAS ERO
Si el balance entre la formación y la eliminación de ERO se altera y ocurre una acumulación anormal de estos radicales se da lugar a la condición de Estrés Oxidativo. Las ERO pueden inducir reacciones en cadena que pueden dañar otras moléculas de importancia biológica, por lo que un oxidante o grupo de oxidantes puede atacar de manera concertada a lípidos, proteínas o ácidos nucleicos, lo que puede conducir a reacciones solapadas y divergentes que modifican simultáneamente varias funciones celulares. Ejemplo sustantivo lo tenemos a nivel molecular con el factor regulador de la transcripción NF-Kb, al regular y modular a través de la concentración de antioxidantes y pro oxidantes la síntesis de biomoléculas como las citocinas e interferones entre otros, con su trascendente papel en la defensa y respuesta de la economía humana.
La acción de las ERO se manifiesta en todos los niveles de organización celular y molecular de los seres vivos. Los daños iniciales pueden preceder la aparición de manifestaciones clínicas, por lo que el diagnóstico a nivel molecular puede servir para el diagnóstico precoz o presintomático como puede ser el caso del uso de la mieloperoxidasa en la enfermedad cardiovascular recientemente descrita, y en consecuencia, puede aumentar las posibilidades de prevención y de esta forma lograr un tratamiento mas eficaz, si se ha llegado a una situación reversible como la que resulta de la exposición a genotóxicos.
Además de las vías metabólicas generadoras de radicales libres, existe otra fuente de radicales libres que está ligada al daño al endotelio: las células del sistema reticuloendotelial local. La repuesta de estas células puede ser muy variada, como la activación de la producción de ERO a través de la NADPH-oxidasa. Esta enzima está asociada a la membrana de los leucocitos polimorfo nucleares, y participa en la activación de la síntesis de leucotrienos y el inicio de la síntesis de moléculas que median la adhesión, la migración y la diapédesis de los linfocitos polimorfonucleares al endotelio vascular dando lugar ala formación de la placa de ateroma y por ende al proceso de ateroesclerosis con todas sus consecuencias clínicas.
Además de la generación de ERO, los polimorfonucleares y el endotelio activado producen agentes pro inflamatorios, como el factor activador de plaquetas y las citocinas.
Las ERO cumplen también un importante papel como segundos mensajeros en la información celular, especialmente los metabolitos del ácido araquidónico (figura 2) (prostanoides, tromboxanos y leucotrienos) por sus complejos efectos en los mecanismos fisiológicos de los seres vivos, entre otros la regulación del tono vascular y de los bronquios, la respuesta inflamatoria y sus consecuencias.
La peroxidación lipídica es un factor determinante en el mecanismo del daño oxidativo. Los lipoperóxidos producen también modificaciones de las proteínas asociadas con las membranas, las enzimas, los receptores y las proteínas formadoras de canales, lo que provoca trastorno de los sistemas transportadores de membrana por el aumento de la permeabilidad para algunos elementos como el Ca++.
Los lipoperóxidos difunden a través de la membrana y alteran su estructura y función, o pueden oxidar moléculas vecinas, dañar proteínas y el ADN. El daño de las proteínas provoca cambios conformacionales con modificaciones funcionales de las enzimas, los receptores, las moléculas transportadoras de iones de membrana y los mensajeros celulares. En el ADN causan la formación de aductos o sitios abásicos que generan rupturas de la cadena simple o mutaciones, o también la ruptura de cadenas dobles y de enlaces cruzados entre moléculas de ADN ó de ADN con proteínas y por tanto conduce a la generación de daño irreversible en la estructura de ácidos nucleicos y su expresión en procesos tales como envejecimiento y Alzheimer, entre otros, solo por citar algunos de los más relevantes.
Las ERO también desempeñan un papel importante como mediadoras del efecto negativo que tienen los contaminantes ambientales en la salud humana. Los contaminantes reaccionan con macromoléculas y blancos celulares críticos y afectan la integridad y funcionamiento celular, lo que incide en la patogénesis de diversas enfermedades, el envejecimiento y los procesos de necrosis y apoptosis relacionados con el cáncer. La exposición ambiental a radiaciones ultravioletas e ionizantes, metales pesados, agentes químicos, anoxia o hiperoxia y el ejercicio físico no adecuadamente programado conllevan un aumento de la producción de ERO. Los cambios asociados con el daño oxidativo y la restauración de la homeostasis celular llevan a la activación o apagado de genes que codifican para factores regulatorios de la transcripción, enzimas de defensa antioxidante y proteínas estructurales.
De esta manera, los radicales desempeñan un papel relevante en el desarrollo de muchas enfermedades y procesos, mientras que en otros pueden estar implicados en la fisiopatología primaria.
MECANISMOS ANTIOXIDANTES
Los principales componentes de los mecanismos antioxidantes de defensa que existen en el organismo son:
- Las barreras fisiológicas que enfrenta el oxígeno a su paso, desde la inspiración hasta llegar a las células
- Las enzimas, como la superóxido dismutasas (SOD), la catalasa (CAT), la glutatión peroxidasa, la glutatión reductasa y los sistemas regeneradores de NADPH
- Los compuestos antioxidantes tisulares, como las vitaminas A, E y C, el selenio, los aminoácidos sulfurados y la coenzima Q10
- Las moléculas transportadoras de metales, como la transferrina y la ceruloplasmina.
Las enzimas protectoras parecen diseñadas para destruir rápidamente los radicales libres y mantener en el organismo niveles tisulares normales de sus sustratos. La Cobre-Zinc Superóxido dismutasa (SOD) es una enzima citosólica de bajo peso molecular que participa en la siguiente reacción como catalizador, mientras que la catalasa y la glutatión peroxidasa están encargadas de transformar el H2O2 en agua y oxigeno, de la siguiente forma:
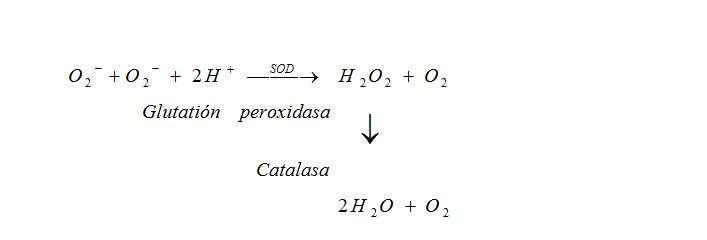
Estos mecanismos nos garantizan por ende que la formación de estas especies reactivas del oxigeno que se forman durante el fisiologismo celular queden neutralizadas evitando que el exceso de EROs nos conduzca a la situación de Estrés Oxidativo.
Utilizando las herramientas que nos proporciona la bioinformática, a punto de partida del impetuoso desarrollo de la proteómica en nuestro tiempo después de los descubrimientos del genoma humano, podemos comparar la composición aminoacídica de estos sistemas enzimáticos antioxidantes, de acuerdo con su fuente y el número total de residuos de aminoácidos, donde se puede observar que existe una gran similitud, y la diferencia se limita a dos residuos aminoacídicos, excepto en el caso de la E. coli (cuadro 1). Desde el punto de vista filogenético existe una extraordinaria similitud entre los sistemas enzimáticos encargados de la defensa antioxidante de muy diversas especies (figura 1). Este alto grado de conservación entre diferentes organismos confirma la apreciación de que estos sistemas enzimáticos son resultado de la presión evolutiva. De esta forma podemos utilizar algunos de estos modelos.
MECANISMOS O MEDIDAS DE PROTECCIÓN CONTRA EL ESTRÉS OXIDATIVO
Existe fuerte evidencia, a partir de estudios clínicos y de intervención, así como también a partir de investigaciones básicas, de que los antioxidantes podrían prevenir o retardar el desarrollo de enfermedades. Puede haber también poblaciones particulares que se beneficiarían de un consumo incrementado de antioxidantes, tal es el caso de las mujeres embarazadas, los neonatos y los niños, los ancianos, y quizás los deportistas.
Se debe establecer esquemas que ayuden a mitigar el daño oxidativo mediante dietas equilibradas, fundamentalmente ricas en vegetales y especialmente aquellas aun por definir que reúnan estas propiedades específicamente para nuestra Región para evitar el abuso de antioxidantes comerciales. Si bien el uso de suplementaciones conduce a posibilidades de disminuir las insuficiencias que se generan como consecuencia de la desnutrición o dietas poco equilibradas, no es menos cierto que paradójicamente el abuso se convierte en causa de estrés oxidativo.
Uno de los efectos más estudiados acerca del papel de los antioxidantes en relación a una enfermedad ha sido la enfermedad cardiovascular, debido entre otras razones a su extraordinaria importancia medico-social al estar considerada entre las primeras causas de muerte, y sus secuelas de invalidez y de afectación de la calidad de vida, lo justifica. Esto sin tener en cuenta que es ciencia constituida que la causa primaria de la aterosclerosis, en relación con los depósitos lipídicos, que se forman en el espacio subendotelial están causados por el estrés oxidativo, particularmente la oxidación de la LDL. La oxidación de la LDL, ocurre debido a una reacción de peroxidación lipídica (POL) iniciada por los radicales libres (RL). Investigaciones por separado de los lípidos y de las proteínas oxidadas de la LDL demostraron que las modificaciones oxidativas de ambas biomoléculas contribuyen a las propiedades proaterogénicas de la LDL oxidada. La oxidación de la LDL es eficientemente inhibida por antioxidantes lipofílicos, de los cuales el alfa-tocoferol parece ser el más importante. Otros efectos del RRR-alfa-tocoferol, independiente de su actividad antioxidante, han sido relacionados con las propiedades de este compuesto. Un evento temprano en el desencadenamiento de la aterosclerosis es la migración de las células musculares lisas desde la capa media a la capa íntima de la pared arterial, seguida de una proliferación de estas células. Se asegura que el RRR-alfa-tocoferol actúa como un regulador negativo de la proliferación de las células musculares lisas por medio de la modulación de la actividad de la proteína quinasa C.
. Generalmente los estudios epidemiológicos han mostrado que un consumo incrementado de antioxidantes (vitamina E, vitamina C y beta-caroteno) está asociado con un riesgo más bajo de daño isquémico al corazón. Estos datos son al parecer muy convincente en lo que concierne a la vitamina E. Otro estudio comparó nuevos y ya establecidos factores de riesgo de la enfermedad coronaria en una población compuesta por hombres de mediana edad de Suecia y de Lituania, así como en un grupo de Finlandia. En esta última se manifestó una mortalidad por enfermedad coronaria cuatro veces más alta. Las vitaminas antioxidantes (ganma-tocoferol, beta-caroteno y licopeno) y las mediciones ex-vivo de la LDL y de la resistencia en suero de la oxidación inducida por cobre indicaron un nivel más bajo de antioxidantes en la población de Finlandia, implicando una responsabilidad del estrés oxidativo en esta patología.
En general, las observaciones basadas en datos epidemiológicos tienen algunas limitaciones en establecer un efecto causal, teniendo en cuenta que el estilo de vida y los micronutrientes no considerados pudieran ejercer confusión. Sobre esta base, es importante también llevar a cabo ensayos clínicos aleatorios para evaluar los efectos de los antioxidantes en la prevención de la enfermedad aterosclerótica. Hasta la fecha, se han reportado pocos ensayos de intervención aleatorios. En un estudio con a-tocoferol/b-caroteno (primariamente designado para investigar la incidencia de cáncer en relación con el consumo de vitamina E), se le administró a una población numerosa de hombres fumadores de Finlandia a-tocoferol (50 mg/día) o placebo y b-caroteno o placebo, de forma aleatoria durante un intervalo de tiempo entre 5 y 7 años. Los efectos beneficiosos en la enfermedad cardiovascular fueron muy modestos (The Alpha-tocopherol, Beta carotene Cancer Prevention Study Group, 1994). De cualquier manera, debe puntualizarse que la dosis de vitamina E utilizada fue mucho más baja que la que se ha sugerido que puede ejercer efectos protectores a partir de otros estudios epidemiológicos. Consideraciones similares pueden aplicarse a otro gran estudio llevado a cabo en China, donde se combinaron la vitamina E, el b-caroteno y el selenio.
Resultados muy alentadores se obtuvieron en otra investigación en Cambridge al emplear antioxidantes en la enfermedad coronaria. Un grupo de alrededor de 2000 pacientes con esta patología recibió vitamina E (400 o 800 UI diariamente) o placebo; la suplementación resultó en una reducción de infarto no fatal del miocardio y de otros principales eventos cardiovasculares.
Otro ensayo de prevención secundaria consistió en el suministro de 400 IU por día de vitamina E y/o 10mg por de ramipril, un fármaco inhibidor de la ACE a 9500 hombres y mujeres canadienses. Después de un seguimiento por 4 años, la vitamina E no mostró efectos beneficiosos estadísticamente significativos, mientras el ramipril protegió contra varios accidentes cardiovasculares (Yusuf et al. 2000; Yusuf et al 2000).
Los resultados de ensayos clínicos aleatorios actualmente no aportan una información lo suficientemente fuerte sobre el uso de la vitamina E y de otros antioxidantes como agentes terapéuticos, pero tampoco contradicen la hipótesis del estrés oxidativo de la aterosclerosis. De hecho, como ha sido planteado en otras ocasiones, los antioxidantes son clínicamente de gran utilidad en los estados iniciales de la aterosclerosis y siguiendo una terapia que abarque muchos años. No obstante, es posible que la administración de vitamina E no sea beneficiosa en grupos de pacientes en los cuales, la progresión de las lesiones ateroscleróticas dependa del estado del miocardio así como de la pared arterial.
Tres estudios epidemiológicos a gran escala demostraron una relación entre el consumo de vitamina E y la enfermedad coronaria. El Estudio de Salud de las Enfermeras, conducido en 87 245 mujeres, encontró una reducción significativa del 34 % en esta enfermedad en mujeres que habían consumido suplementos de vitamina E que contenían más de 67 equivalentes de alfa-tocoferol diarios (RRR-a-tocopherol) por más de dos años. El estudio de los profesionales de la salud, con 39 910 hombres, mostró que el consumo de la vitamina E estuvo asociado con una reducción del 41 % del riesgo de enfermedad coronaria. También la mayor reducción del riesgo fue encontrada con consumos de suplementos de más de 67 equivalentes de alfa-tocoferol diarios por más de dos años. Kushi et al reportaron una reducción significativa del 62 % en la mortalidad por enfermedad coronaria en mujeres que consumieron más de 6.46 equivalentes de alfa-tocoferol diarios. Sorprendentemente, no se evidenció una disminución del riesgo al usar suplementos de vitamina E. Los autores plantearon que esto pudo suceder por pérdida de información en la duración del uso del suplemento, tomando en cuenta que en otros estudios se ponen de manifiesto los efectos beneficiosos de los suplementos solo después de dos años.
Algunos estudios epidemiológicos han examinado la asociación entre la vitamina C y la enfermedad cardiovascular. Un estudio en Europa encontró una relación significativamente inversa entre la mortalidad por enfermedad coronaria y los niveles en suero de esta vitamina. Los resultados de la primera inspección de la salud nacional y el reconocimiento nutricional mostraron una reducción del 50 % en la mortalidad cardiovascular asociada con un consumo diario de más de 50 mg de vitamina C. Gale et al reportaron un efecto protector significativo contra el ictus por parte de consumos de vitamina C mayores de 45 mg. Sin embargo, ni el estudio de salud de las enfermeras, ni el estudio de salud de los profesionales mencionados arriba, encontraron un efecto protector significativo de la vitamina C en la enfermedad coronaria.
Otro estudio encontró que el uso de suplementos combinados de vitamina E y C protegió mucho más contra la morbi-mortalidad cardiovascular que el uso de suplementos de vitamina E solos.
Las evidencias epidemiológicas en relación con el papel de los carotenoides en la prevención de la enfermedad cardiovascular han sido revisadas por Kohlmeier & Hastings. Un gran cúmulo de estudios han reflejado una disminución del riesgo de padecer de esta enfermedad entre sujetos con altos consumos o altos niveles en suero de beta-caroteno. En un estudio Panel del Cuidado de la Salud en Massachusetts, con 1299 personas mayores, Gaziano et al. encontraron una reducción del 75 % del riesgo de infarto fatal al miocardio en sujetos con el consumo más alto de carotenos. Otro estudio con 25 802 sujetos mostró un aumento del riesgo de infarto del miocardio en individuos con bajos niveles en suero de beta-caroteno (Street et al., 1994). Algunas investigaciones han revelado sin embargo aumento en el riesgo de enfermedad coronaria entre sujetos con bajos niveles de beta-caroteno. Este riesgo parece ser confinado a fumadores corrientes. Sin embargo, el consumo de beta-caroteno contribuye en alrededor de un 25 % al consumo de carotenoides totales; de esta manera, otros carotenoides además del beta-caroteno y de otros componentes en las frutas y los vegetales, pudieran ser responsables de estos resultados. Algunos compuestos bioactivos no nutritivos pueden ser de relevancia en la etiología de la enfermedad cardiovascular. Los estudios epidemiológicos con flavonoides son promisorios, pero la evidencia de sus beneficios está todavía fragmentada.
Numerosos estudios en humanos han investigado los efectos de la suplementación de la vitamina C, en combinación con la vitamina E o el beta-caroteno, o con ambos, en la oxidación de la LDL. Los estudios se han realizado en fumadores, en no fumadores y en personas con hipercolesterolemia o enfermedad cardiovascular. En todos los casos se observó una reducción significativa en la oxidación de la LDL. Sin embargo, es difícil determinar la contribución relativa de la vitamina C en estos estudios por la presencia de los cosuplementos, de los cuales la vitamina E parece ser el principal contribuyente en la protección a la LDL.
Algunas investigaciones en relación con la oxidación de la LDL han sido llevadas a cabo utilizando vitamina C como único suplemento. Aunque dos estudios no reportaron efectos, otros dos estudios sí encontraron una reducción significativa en la oxidación de la LDL. Sin embargo, existen planteamientos sobre la dificultad de racionalizar estos resultados, teniendo en cuenta que la vitamina C, siendo hidrosoluble, es removida de la LDL durante su aislamiento del plasma.
Con relación a la vitamina C también se han estudiado los efectos de su administración sobre marcadores de la peroxidación lipídica en individuos fumadores. Los fumadores presentaron valores más altos de peroxidación lipídica y más bajos de vitamina C en plasma en comparación con los individuos no fumadores. Tres estudios reportaron una reducción en los marcadores de la oxidación lipídica con suplementos de vitamina C. Particularmente interesante fue el estudio de Reilly et al, ya que ellos encontraron que la suplementación con 2000 mg de vitamina C por día a fumadores crónicos durante solo 5 días, redujo significativamente la excreción urinaria del 8-iso PGF 2alfa, un biomarcador específico de la peroxidación lipídica.
| Estudio | Diseño | Intervención | Publicación | Observaciones |
| Clínico de Cleveland. 2002 | Análisis de:
7 ensayos con Vit E 8 ensayos con b car Al menos 1000 pts Tto 1-12 años |
Vit E:
b car: |
Lancet 2002;Nov | Vit E. No disminuyó la mortalidad en relación al grupo control
b car. |
| NHLBI
Estudio WAVE (Women´s Angiographic Vit & Estrogen) (EU y Canadá) |
423 Mujeres postmenopausicas con enfermedad cardiaca | Estrógeno conjugado 0.625 MG de Premarin (muj sin útero)
Estrógeno conjugado y medroxiprogesterona 2.5 MG y/o Vit E 400 UI Vit C 500 MG |
JAMA 2002 | Más o igual progresión de la enfermedad coronaria |
| Inst Nacional Desórdenes Neurológicos
Univ California |
80 pacientes con Enf. de Parkinson
Seguimiento hasta 16 meses Estudio fase II |
Coenzima Q (300, 600 y 1200 MG/d)
Vit E |
Arch Neurology Oct 15, 2002 | 44% menos del declinar de la función mental y motora |
| Am Heart Association | No recomienda aún el uso de suplementos con vit ao | |||
| US Preventive Service Task Force (PSTF) | Evidencias insuficientes para recomendar o para oponerse a suplementos con vitaminas antioxidantes o multivitaminas en la prevención, en particular los b car. | Ann Intern Med 2003;139:51-55 | Más apropiado para dietas carenciales | |
| Progresión atero carotídea | Progresión atero carotídea | a tocoferol 91 mg (±136 UI Vit E)
Vit C de liberación lenta (250 MG) |
Circulation 2003;107:947-53 | Dism espesor de íntima media |
| Enf coronaria y DM | Enfd coronaria y DM | Vit C 2 G/d | Mejora la función endotelial | |
| Stents coronarios | AGI-1067 (Sim Probucol): 70, 140, 280 MG (2-4 sem) | Dism restenosis dp de colocación de stents coronarios, Aum área vascular | ||
| DM+Angina estable | Vit E 600 UI/d
Vit C 2 g/d 2 meses |
Mejora la función endotelial
Dism rigidez aórtica en DM+angina estable |
||
| Insuf. Cardíaca Congestiva | Vit C 2.5 g bolo IV
2g V.O./3d |
Inhib apoptosis en cél endot | ||
| HTA
|
Vit C 500 MG/d | Aum biodisponibilidad de NO | ||
| Preclampsia | Vit C 1 G/d
Vit E 400 UI/d |
Dism índice PAI-1/PAI-2 | ||
| Alzheimer | Vit E 2G/d | Prevención del deterioro de funciones cognitivas | ||
| DM | Ac lipóico 600 MG/d | Dism trombomodulina plasm
No aum albúmina en orina |
||
| DM+polineuropatía | Ac lipóico 600 MG
14 dosis/3 sem |
|||
Como se pone en evidencia en la tabla anterior el tema de usar o no antioxidantes es aun controvertido y no conclusivo, sin embargo esta afectado por las dosis empleadas de los antioxidantes y sus ineracciones, dando lugar en muchos casos a respuestas insatisfactorias partiendo de la consideracion que no se conoce el estado antioxidante de la persona y la suplementación no resulta equilibrada o excesiva en muchos casos.
El diseño de muchos de estos ensayos esta afectado por estas insuficiencias, lo que nos tiene que motivar a ser extraordinariamente cuidadosos al aprobar o desarrollar un ensayo, considerando que el diseño de este se convierte en la piedra angular de su exito.
Los profesionales deben conocer mejor la composición antioxidante de las dietas y el patrón de respuesta antioxidante, con vistas a poder aconsejar la suplementación dietética adecuada y brindar información acerca de este tema. El médico debe conocer las herramientas diagnósticas con que cuenta en la actualidad y sus posibilidades de implementación e interpretación.
Estas son consideraciones que ameritan el abordaje de este actual problema, aún incipiente y muy controvertido.
Cuadro 1. Residuos de aminoácidos
| Origen | Cu-Zn, Superóxido dismutasa | Catalasa | Glutatión peroxidasa |
| Humana | 153 | 526 | 202 |
| Bacteriana | 160 | ||
| Ratón | 153 | 526 | 201 |
| Puerco | 152 | 502 | |
| Conejo | 152 | 200 | |
| Ovejo | 151 | ||
| Levadura | 153 | 515 | 167 |
| E. coli | 173 | 726 | |
| Pollo | 153 | ||
| Bovino | 151 | ||
| Rata | 153 | 526 | 201 |
| Drosófila | 506 |
CUADRO 2. Algunas enfermedades en cuyos mecanismos etiopatogénicos o esquemas terapéuticos están involucrados los radicales libres o ERO
| Enfermedad | Mecanismos en que participa |
| Quemaduras
Parkinson Alzheimer Diabetes Isquemia-Reperfusión Hipertensión Arterial Disfunción endotelial Cáncer Ataxia tipo II Retinosis pigmentaria Renal Asma Enfermedad Periodontal |
Daño oxidativo a biomoléculas: ADN, proteínas, lípidos
Daño oxidativo a proteínas y lípidos Daño oxidativo a proteínas y lípidos Daño oxidativo a proteínas y lípidos Daño oxidativo a proteínas y lípidos Daño oxidativo a proteínas y lípidos Daño oxidativo a proteínas y lípidos Daño oxidativo a biomoléculas Daño oxidativo a biomoléculas Daño oxidativo a biomoléculas Daño oxidativo a proteínas y lípidos Burst o estallido respiratorio Daño oxidativo a proteínas y lípidos |
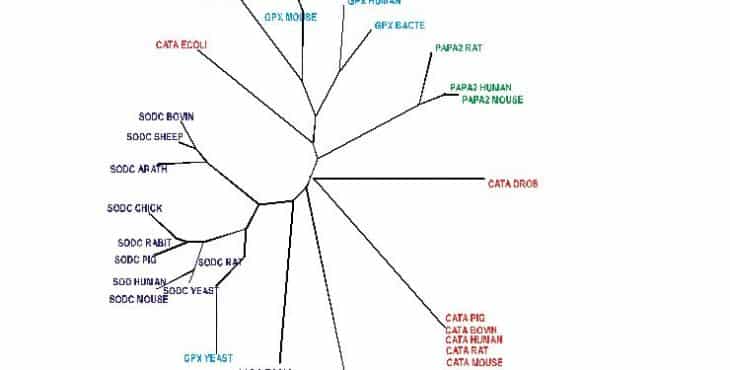
SOD Cu-Zn, SUPEROXIDO DISMUTASA
GPX GLUTATION PEROXIDASA
Como puede apreciarse los diferentes sistemas enzimáticos estudiados se agrupan desde el punto de vista filogenético en virtud de la similitud estructural, lo que nos acerca al pensamiento de que son consecuencia de diferencias no esenciales que parten de un tronco común, relacionados con la importante función biológica que cumplen como parte de los mecanismos de defensa antioxidante. Nótese que para Catalasa, SOD y GPX la única excepción es la E. coli como fuente.
REFERENCIAS
1. Broche F, Romero A, Olembe E, Céspedes E, Peña M, Romay C, José C. García
Piñeiro Aprotinin mediated antioxidant effect in cardiosurgery with mechanical
cardiorespiratory support J Cardiovasc Surgery Aug;43(4):429-36,2002
2. Celia Bauby, Dahis Manzanares, Cheyla Romay, Rosa Sánchez, Jorge L. López,
Roberto de la Peña y José C. García Piñeiro Efecto de la a-cristalina bovina en
la respuesta oxidativa de los polimorfonucleares en la peroxidación lipídica
Rev Cubana Invest Biomed 20(1),2001
3. Nayade Pereira Roche, Mónica Bequet Romero, Ana K. Martínez Bermúdez,
Dahis Manzanares y José Carlos García Piñeiro Evaluación de la capacidad
protectora de la a-cristalina en el endotelio vascular Rev Cubana Invest Biomed
20 (1), 2001
4. Alberto Saldaña, Bárbara Elena García, José Carlos García Piñeiro y Lázaro
Capote El daño oxidativo en la
vasculopatía postrasplante/ Oxidative damage in posttransplant vasculopathy
Rev Cubana Invest Biomed 20 (3), 2001
5. Alberto Saldaña Bernaben, Bárbara Elena García Triana, Antonio Enamorado
Casanova y José Carlos García Piñeiro El estrés oxidativo en la fisiopatología
del trasplante renal Rev Cubana Invest Biomed 19(3),2000
6. Ela Céspedes, Fernando Fernández, Juan C. Rodríguez, Niurka Llópiz, Massiel
del Rosario, Pedro López y José C. García Piñeiro Caracterización de
indicadores bioquímicos de estrés oxidativo en el asma bronquial Rev Cubana
Invest Biomed 19(3),2000
7. Rosa Sánchez, Niurka Llópiz, Lirian Leyva, Yoani Albuerne, Félix Broche, Marisol
Peña, Yuladis González y José C. García Piñeiro Caracterización de
indicadores bioquímicos de estrés oxidativo en pacientes quemados muy
graves Rev Cubana Invest Biomed 19(3),2000
8. García B, José C. García Piñeiro , Broche F, Rodríguez P, Rodríguez V, Saldaña
A La peroxidación lipídica en la enfermedad periodontal inflamatoria» Rev Cub
Estomatol 35(2):62-7,1998
9. González ME, Céspedes E, Arencibia R, Castellanos O, José C. García Piñeiro
Oxidative Stress Indicators and Effect of the Antioxidant Treatment in Patients
with Primary Parkinson’s Disease. Rev Neurol 26(149):28-33,1998
10. Broche F, Céspedes E, José C. García Piñeiro, Castillo J Molecular bases of left
ventricular hypertrophy: Role of the oxidative stress Rev Cub Invest Biomed
16(2):84-93 154, 1997
11. Broche F, Romero A, Olembe E, Fernández G,Céspedes E, José C. García
Piñeiro, Reynoso E,Nuñez P, Prieto E. Aprotinin Effects Related to Oxidative
Stress in Cardiosurgery with Mechanical Cardiorespiratory Support (CMCS)».
Ann N Y Acad Sci 793:521-524, 1996
12. García Piñeiro José Carlos, Rev Cub Invest Biomed 14(1):1995Especies
Reactivas del oxígeno y Cáncer (Mecanismos de acción carcinógenos,
prevención, diagnóstico y terapéutica).
13. Abbey M, Noakes M, Nestel PJ. Dietary supplementation with orange and carrot
juice in cigarette smokers lowers oxidation products in copper-oxidized low-
density lipoproteins. J Am Diet Assoc 1995; 95: 671-675.
14. Azzi A, Boscoboinik DO, Marilley D, Ozer NK, Stauble B & Tasinato A. Vitamin E:
a sensor and an information transducer of the cell oxidation state. American
Journal of Clinical Nutrition 1995; 62: 1337S–1346S.
15. Berliner JA & Heinecke JW. The role of oxidized lipoproteins in atherogenesis.
Free Radical Biology and Medicine 1996; 20: 707–727.
16. Blot WJ, Li JY, Taylor PR, Guo W, Dawsey S, Wang GQ, et al. Nutrition
intervention trials in Linxian, China: supplementation with specific
vitamin/mineral combinations, cancer incidence, and disease-specific mortality
in the general population. J Natl Cancer Inst 1993; 85: 1483-92.
17. Cross CE, Halliwell B. Nutrition and human disease: how much extra vitamin C
might smokers need?. Lancet 1993; 341:1091.
18. Diplock AT. Antioxidants and disease prevention. In Molecular Aspects of
Medicin 1995; 15: 295–376 [H Baum, editor]. Oxford and New York: Pergamon
Press.
19. Diplock AT (1995) Safety of antioxidant vitamins and b-carotene. American
Journal of Clinical Nutrition 62, Suppl. 6, 1510S–1516S.
20. Esterbauer H, Gebicki J, Puhl H & Jurgens G. The role of lipid peroxidation and
antioxidants in oxidative modification of LDL. Free Radicals in Biology and
Medicine 1992; 13: 341–390.
21. Fuller CJ, Grundy SM, Norkus EP, Jialal I. Effect of ascorbate supplementation
on low density-lipoprotein oxidation in smokers. Atherosclerosis 1996; 119: 139-
50.
22. Gale CR, Martyn CN, Winter PD & Cooper C. Vitamin C and risk of death from
stroke and coronary heart disease in a cohort of elderly people. British Medical
Journal 1995; 310: 1563–1566.
23. Garewal H. Antioxidants in oral cancer prevention. American Journal of Clinical
Nutrition 1995; 62: 1410S–1416S.
24. Gaziano JM, Johnson EJ, Russell RM, Manson JE, Stampfer MJ, Ridker PM, Frei
B, Henekens CH & Krinsky NI. Discrimination in absorption or transport of b-
carotene isomers after oral supplementation with either all-trans- or 9-cis-b-
carotene. American Journal of Clinical Nutrition 1995: 61: 1248–1252.
25. Gilligan DM, Sack MN, Guetta V, et al. Effect of antioxidant vitamins on low
density lipoprotein oxidation and impaired endothelium-dependent vasodilation
in patients with hypercholesterolemia. J Am Coll Cardiol 1994; 24: 1611-1617.
26. Harats D, Ben-Naim M, Dabach Y, et al. Effect of vitamin C and E
supplementation on susceptibility of plasma lipoproteins to peroxidation
induced by acute smoking. Atherosclerosis 1990; 85: 47-54.
27. Harats D, Chevion S, Nahir M, Norman Y, Sagee O, Berry EM. Citrus Fruit
supplementation reduces lipoprotein oxidation in young men ingesting a diet
high in saturated fat: presumptive evidence for an interaction between vitamins
C and E in vivo. Am J Clin Nutr 1998; 67: 240-245.
28. Hertog MGL, Hollman PCH & van de Putte B. Content of potentially
anticarcinogenic flavonoids in tea infusions, wines and fruit juices. Journal of
Agricultural and Food Chemistry 1993; 41: 1242–1246.
29. Jarvinen R, Knekt P. Vitamin C, smoking and alcohol consumption. In: Parker L,
Fuchs J. eds. Vitamin C in health and disease. New York: Marcel Dekker
Inc.1997: 425-455.
30. Jialal I, Grundy SM. Effect of combined supplementation with alfa-tocopherol,
ascorbate, and beta-carotene on low-density lipoprotein oxidation. Circulation
1993; 88:2780-2786.
31. Kohlmeier L & Hastings SB. Epidemiologic evidence of a role of carotenoids in
cardiovascular disease prevention. American Journal of Clinical Nutrition 1995;
62: 1370S–1376S.
32. Kristenson M, Zieden B, Kucinskiene Z, Abaravicius A, Razinkoviene L, Elinder
LS. Antioxidant state and mortality from coronary heart disease in Lithuanian
and Swedish men: concomitant cross sectional study of men aged 50. BMJ (Br
Med J) 1997; 314: 629-33.
33. Kushi LH, Fulsom AR, Prineas RJ, Mink PJ, Wu Y & Bostick RM. Dietary
antioxidant vitamins and death from coronary heart disease in postmenopausal
women. New England Journal of Medicine 1996; 334: 1156–1162.
34. Losonczy KG, Harris TB & Havlik RJ. Vitamin E and vitamin C supplement use
and risk of all-cause and coronary heart disease mortality in older persons: the
Established Populations for Epidemiologic Studies of the Elderly. American
Journal of Clinical Nutrition 1996; 64: 190–196.
35. Luis A & Navab M. Lipoprotein oxidation and gene expression in the artery wall.
Biochemical Pharmacology 1993;46: 2119–2126.
36. McCall MR, Frei B. Antioxidant vitamins: evidence from biomarkers in humans.
In: Walter P.ed. Evidence for vitamin functions beyond RDAs. Basel.
Switzerland: Karger (in press).
37. Morrow JD, Frei B, Longmire AW, et al. Increase in circulating products of lipid
peroxidation (F2-isoprostanes) in smokers. N Engl J Med 1995; 332: 1198-1203.
38. Mosca L, Rubenfire M, Mmandel C, et al. Antioxidant nutrient supplementation
reduces the susceptibility of low-density lipoprotein to oxidation in patients with
coronary artery disease. J Am Coll Cardiol 1997; 30: 392-399.
39. Muldoon M & Kritchevsky SB. Flavonoids and heart disease. British Medical
Journal 1996; 312: 458–459.
40. Nyyssonen K, Porkkala E, Salonen R, Korpela H, Salonen JT. Increase in
oxidation resistance of atherogenic serum lipoproteins following antioxidant
supplementation: a randomized double-blind placebo-controlled clinical trial. Am
J Clin Nutr 1994; 48: 633-642.
41. Nyyssonen K, Poulsen HE, Hayn M, et al. Effect of supplementation of smoking
men with plain or slow-release ascorbic acid on lipoprotein oxidation. Eur J Clin
Nutr 1997; 51: 154-163.
42. Özer NK, Boscoboinik DO & Azzi. New roles of lipoproteins and vitamin E in the
pathogenesis of atherosclerosis. Biochemistry and Molecular Biology
International 1995; 35: 117–124.
43. Reilly M, Delanty N, Lawson JA, Fitzgerald GA. Modulation of oxidant stress in
vivo in chronic cigarette smokers. Circulation 1996; 94: 19-25.
44. Riemersma R.A, Wood DA, MacIntyre CCA, Elton RA, Gey KF. Risk of angina
pectoris and plasma concentrations of vitamins A, C, and E and carotene. Lancet
1991; 337: 1-5.
45. Rifici VA, Khachadurian AK. Dietary supplementation with vitamins C and E
inhibits in vitro oxidation of lipoproteins. J Am Coll Nutr 1993; 12: 631-637.
46. Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA & Willett WC.
Vitamin E consumption and the risk of coronary heart disease in men. New
England Journal of Medicine 1993; 328 : 1450–1456.
47. Samman S, Brown AJ, Beltran C, Singh S. The effect of ascorbic acid on plasma
lipids and oxidisability of LDL in male smokers. Eur J Clin Nutr 1997; 51: 472-
477.
48. Sies H. Antioxidants in Disease Mechanisms and Therapy. London: Academic
Press.
49. Sies H & Stahl W (1995) Vitamins E and C, b-carotene, and other carotenoids as
antioxidants. American Journal of Clinical Nutrition 1997; 62 : 1315S–1321S.
50. Steinberg FM, Chait A. Antioxidant vitamin supplementation and lipid
peroxidation in smokers. Am J Clin Nutr 1998; 68: 319-327.
51. Stephens NG, Parsons A, Schoefield PM, Kelly F, cheeseman K, Mitchinson MJ.
Randomised controlled trial of vitamin E in patients with coronary disease:
Cambridge Heart Antioxidant Study (CHAOS). Lancet 1996; 347: 781-6.
52. Street DA, Comstock GW, Salkeld RM, Schuep W & Klag MJ. Serum antioxidants
and myocardial infarction. Are low levels of carotenoids and a-tocopherol risk
factors for myocardial infarction? Circulation 1994; 90: 1154–1161.
53. The Alpha-tocopherol, Beta carotene Cancer Prevention Study Group. The effect
of vitamin E and beta carotene on the incidence of lung cancer and other
cancers in male smokers. N Engl J Med 1994; 330: 1029-35.
54. van Poppel G, Kardinaal A, Princen H & Kok FJ. Antioxidants and coronary heart
disease. Annals of Medicine 1994; 26: 429–434.
55. Yusuf S, Dagenais G, Pogue J, Bosch J, Sleight P. Vitamin E supplementation
and cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 154-60.
56. Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an
angiotensin-converting- enzyme inhibitor, ramipril, on cardiovascular events in
high- risk patients. N Engl J Med 2000; 342: 145-5
